
“老而不衰”效果合成图

图为蔡时青研究员
科学家发现新的抗衰老靶标基因 中国科学院脑科学与智能技术卓越创新中心供图
“人为什么会衰老,人的寿命到底有没有极限?”“我们能不能实现长生不老、返老还童?”两年前,中国科学院脑科学与智能技术卓越创新中心研究员蔡时青在一个科普论坛上抛出的这些问题,引起了众多同行的关注和提问,他的观点也被一些人概括为“人类已经有望实现‘长生’,而我们的目标却是‘不老’”。
如今,由蔡时青带领的科研团队和中国科学院上海巴斯德研究所的江陆斌研究组历时多年合作,在这个问题上有了新突破:他们发现了新的抗衰老靶标基因,并据此阐明了认知衰老的调控机制,为实现“健康衰老”提供了新的线索。这项成果的论文已于近日在线发表于国际学术期刊《自然》杂志。
“我们每一个人都和衰老有着密切的关系,从出生到成年,再到变老,在后面的过程中,各项生理功能会慢慢退化,甚至会出现一些老年病,衰老也是老年疾病最大的风险因素。”蔡时青在接受记者采访时说,成果发布后最受瞩目的,还是健康长寿这个人类永恒的话题。那么,人类能否借助科学的手段来揭开衰老的面纱,对抗岁月这把在容颜上刻下道道皱纹的“杀猪刀”,又能否抵抗衰老所伴随的疾病,乃至“老而不衰”?
“长生”≠“不老”
尽管几千年来人们一直在追求长生不老,但是现代意义上有关衰老的科学研究时间并不太长。据此次成果论文的第一作者、中国科学院脑科学与智能技术卓越创新中心博士生袁洁介绍,衰老研究的关键起始点是20世纪30年代末期,那时,科学家发现限制饮食可以延长小鼠和大鼠的寿命,这在一定程度上说明“衰老是一个可塑的过程”。
随着新实验方法的出现,人们对于衰老现象从个体到细胞和分子层面都有了进一步的认识,科学家相继提出了很多理论试图解释衰老。20世纪90年代,随着分子生物学的发展,衰老研究进入基因时代,基因和衰老现象之间建立起了因果关系。
一个代表性成果是,1983年,一位科学家在实验动物线虫中鉴定出第一个长寿突变体——一个叫age-1的基因突变,它将线虫寿命延长了40%-60%。这个发现令很多科学家“惊讶”:一个基因的突变,竟然就能改变寿命的长短?
接下来的几十年里,科学家陆续发现了上百个可以延长寿命的基因,对长寿的生物学机理也有了进一步的认识。
这其中一个有意思的发现是:一些长寿基因虽然能“延长寿命”,却不一定能“延缓行为功能的退化和认知功能的退化”。比如,伴随着年龄的增长,老年人的行动能力在不断下降,与衰老相关的退行性疾病,如阿尔兹海默病、癌症、帕金森病、糖尿病等发病率大大增加。
袁洁说,从第一次发现寿命是由基因决定的,到如今已过去几十年,研究人员已经找到许多能够影响寿命的基因和遗传通路,但最近几年人们才发现,寿命的延长并不意味着衰老时行为能力、健康状况的改善,对于“衰老过程中行为退化的机制”到底是什么,人们研究得还很不够。
事实上,一提到衰老研究,许多人会立马想到“长生不老”,却不知其中的“长生”和“不老”意思不同:前者是指寿命延长,而后者却指保持年轻的活力,比如,在50岁时还能拥有30岁时的容貌,在70岁时还能像四五十岁那样活蹦乱跳;不仅如此,“长生”“不老”两者在生物学上,也是由不同的机制所调控。
袁洁说,相比在风烛残年中维持体弱多病的生命,人们更希望老年时期的生活质量得到改善,实现“老而不衰”。也因此,如何减少人类衰老后老年病的发病率,搞清楚“老而不衰”的生物机制,是一道摆在科学界面前的难题。
“寻找真凶”
想要搞清楚行为退化机制,就要找到控制行为退化的基因。但生物体内的基因成千上万,要从中找到“真凶”,其难度堪称“大海捞针”。
袁洁说,在生物学中,为了研究一个基因所发挥的功能,可先将其从基因组中去除,观察生物体会出现哪些异常,从而推测这一基因在生物体中具有何种生理功能。
当然,这个过程一般都是在实验动物——而非人类的身上进行。蔡时青团队所选择的研究对象,是一种叫做“线虫”的实验动物。
蔡时青告诉记者,这种长度只有1毫米左右的小蠕虫,三四天就可以发育成熟产生后代,整个生命周期只有短短3周左右,行为不复杂,却有明显的老化表现,加上这种动物的遗传背景清晰,是生物学家研究衰老常用的动物模型。
当然,即便是在线虫中,检测衰老过程中的行为变化也不容易。有没有一种生物学标记,既方便追踪,反映行为功能的退化,又适合用来大规模筛选?蔡时青团队想到了神经递质系统。
所谓神经递质系统,就是介导大脑神经元之间信号传递的化学物质。袁洁说,在生物体衰老过程中,神经递质功能一旦发生异常,将导致行为功能退化,而改善神经递质功能,则可提高老年人的行为能力。
按照袁洁的说法,如果以神经递质功能变化为指标,在全基因组水平上进行筛选、寻找调控衰老的基因,就能获得相应的候选基因。科研团队通过这种方法找到59个候选基因:其中10个已经被报道与退行性疾病或者细胞老化有关,而剩下49个,则是第一次发现能够影响衰老过程。
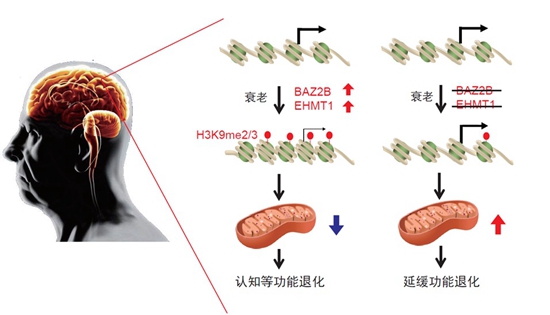
接下来,科研团队构建这些候选基因之间的相互作用网络,这时,他们注意到处于网络中关键节点的两个基因:BAZ-2和SET-6。有意思的是,那些缺失这两个基因的突变线虫,它们的进食能力等各项行为能力,随衰老退化的速度相比其他野生线虫要慢得多,同时还延长了寿命。
“这是很让人欣慰的结果,说明我们设计的筛选系统非常有效。”袁洁说,这个结果说明,BAZ-2和SET-6这两个基因是加速衰老的,相应地,人为地去降低这两个基因的功能,就可以延缓衰老。
人也一样吗
当然,这只是科学家针对线虫实验的结果,人体内也有类似的抗衰老基因吗?
科研团队进一步研究BAZ-2和SET-6这两个抗衰老潜在靶标,找到了它们对应的人类同源基因,分别是BAZ2B和EHMT1。那么,这两种基因就一定抗衰老吗,科研人员还需要做进一步的验证。
这时,一种比线虫更复杂、但和人类亲缘关系更近的实验动物上场了——小鼠。科研人员构建了BAZ2B基因敲除的小鼠,用来验证这种基因的抗衰老机制。
“小鼠的生命周期长达3年,从开始构建基因敲除小鼠,到去除背景突变,最后把小鼠培养到‘年老’,要足足花费3年时间。”蔡时青说,功夫不负有心人,在漫长的实验之后,科研人员得到一个“惊喜的发现”——
野生小鼠会出现“中年发福”的现象,而BAZ2B敲除的小鼠,则能够在衰老过程中,保持更加“苗条”的身材。更重要的是,行为检测的结果表明,年老的BAZ2B敲除小鼠,比野生小鼠保持了更好的认知能力。
“这说明,BAZ2B在哺乳动物中也同样调控衰老进程,是新的抗衰老的靶标基因。”蔡时青说,通过同样的方法,他们也验证了另一个人类同源基因EHMT1的作用机制。
“这是一个全新的发现。”《自然》杂志审稿人给出这样的评价,这些基因的发现,为进一步全面研究衰老过程中行为退化的机制奠定了基础。
更值得期待的是,这两个基因——BAZ2B和EHMT1,很有可能成为抗衰老的药物靶点。蔡时青说,科研团队在此基础上,开始探索这两个抗衰老靶基因在阿尔兹海默病中的变化,结果发现,在阿尔兹海默病人的大脑中,BAZ2B和EHMT1的表达量与疾病进程呈正相关,和关键线粒体蛋白的表达量则呈负相关。
“这些结果表明,BAZ2B和EHMT1在衰老大脑中表达增加,可能是导致阿尔兹海默病线粒体功能缺陷的重要原因。”蔡时青说,这意味着,它们可以作为抗衰老药物靶点的基因。
不过他同时表示,这项研究还有一定的局限性:行为检测和机制研究的对象只是线虫、小鼠,而没有在人体上进行验证,考虑到人类与线虫、小鼠等实验生物存在较大的物种差异,这些研究能否在人体上应用,还存在很大的不确定性。
这也意味着,从科学研究到临床应用还有很长的路要走。蔡时青说:“我们这个工作是世界上第一次从个体衰老速度差异的角度来研究健康衰老,为抗衰老研究提供了一个全新视角。至于这些基因是否在人身上也有相同的功能,还需要进一步研究。” (记者 邱晨辉)
关键词: 抗衰老

















